抗體(tǐ)(Antibody)這個詞首次出現在保羅·埃爾利希1891年10月公布的《免疫力的試驗性研究》這篇文章中(zhōng),德語的抗體(tǐ)“Antikörper”出現在該文章的結論部分(fēn)。其中(zhōng)指出了“如果兩種物(wù)質導緻兩種不同抗體(tǐ)的産生(shēng),那麼這兩種物(wù)質必然是不同的”。然而這一(yī)術語并沒有立即被接受,還有被建議使用的其它幾個術語,如:免疫體(tǐ)(Immunkörper)、介體(tǐ)受體(tǐ)(Amboceptor)、介體(tǐ)(Zwischenkörper)、物(wù)質敏感體(tǐ)(substance sensibilisatrice)、連接體(tǐ)(copula)、德氏體(tǐ)(Desmon)、白(bái)細胞素(philocytase)、介體(tǐ)固定體(tǐ)(fixateur)以及免疫素(Immunisin)等。抗體(tǐ)和抗毒素(Antitoxin)字面結構相似,概念則和免疫體(tǐ)(Immunkörper)類似。
根據E. Padlan公布的抗體(tǐ)結構圖,朱利·安沃斯-安德烈*為斯克裡普斯研究所佛羅裡達分(fēn)部創作了雕塑《西方天使》(2008年)塑像仿照列奧納多·達·芬奇的維特魯威人,将抗體(tǐ)放(fàng)置到一(yī)個圓環的中(zhōng)間,寓意其對于人類的重要意義。
針對抗體(tǐ)的研究始于1890年,埃米爾·阿道夫·馮·貝林及北(běi)裡柴三郎首次描述了抗體(tǐ)對白(bái)喉及破傷風痙攣毒素的抵抗作用。他們兩人将體(tǐ)液免疫理論往前推進了一(yī)步,提出了血清中(zhōng)存在一(yī)種可以與外(wài)來抗原相反應的某種介質的假設。保羅·埃爾利希受到了他們的這一(yī)想法的啟發,于1897年提出了抗體(tǐ)與抗原互動的側鍊理論假說。他假設道,在細胞的表面存在能和特定毒素發生(shēng)一(yī)把鑰匙對應一(yī)把鎖類似的特異結合作用的感受器,而結合反應則會進一(yī)步導緻相關抗體(tǐ)的生(shēng)産。其他研究人員(yuán)在之後的研究中(zhōng)認為,抗體(tǐ)可以在血液中(zhōng)穩定獨立存在。在1904年,奧姆羅斯·萊特進一(yī)步提出通過可溶性抗體(tǐ)在細菌的表面包裹标識,使其成為吞噬作用的目标,并最終被消滅。這一(yī)過程被他命名為調理作用。
到了二十世紀二十年代,邁克爾·海德堡和奧斯瓦爾德·埃弗裡觀察到抗原可以被抗體(tǐ)所凝結,并進一(yī)步發現抗體(tǐ)是一(yī)種蛋白(bái)質。在三十年代,約翰·馬拉克對抗原-抗體(tǐ)結合活動的生(shēng)物(wù)化學性質做了更詳盡的實驗。接下(xià)來的一(yī)次重大(dà)突破發生(shēng)在四十年代,萊納斯·鮑林通過抗體(tǐ)抗原的互動能力取決于各自的形狀而不是其化學成分(fēn),證明了埃爾利希所提出的一(yī)把鑰匙配一(yī)把鎖的免疫學理論。1948年,阿斯特麗德·法戈瑞奧司發現B細胞的其中(zhōng)一(yī)種形式漿細胞就是負責生(shēng)産抗體(tǐ)的工(gōng)廠。
此後,研究工(gōng)作的重點轉向了識别抗體(tǐ)蛋白(bái)質結構中(zhōng)各部分(fēn)的作用。二十世紀六十年代,傑拉爾德·埃德爾曼和約瑟夫·蓋裡發現了抗體(tǐ)的輕鍊,并且發現這和1845年由亨利·本冊·瓊斯所發現的本周氏蛋白(bái)質是同一(yī)種物(wù)質,這是一(yī)項重大(dà)的突破。緊接着,埃德爾曼在進一(yī)步發現抗體(tǐ)中(zhōng)的重鍊和輕鍊是由雙硫鍵連接在一(yī)起的。與此同時,羅德尼·羅伯特·波特識别出了免疫球蛋白(bái)的抗體(tǐ)結合區(Fab)及抗體(tǐ)尾部的可結晶區。根據這些發現,科學家們對免疫球蛋白(bái)的結構進行了推測,并描述了IgG蛋白(bái)質的完整氨基酸序列。
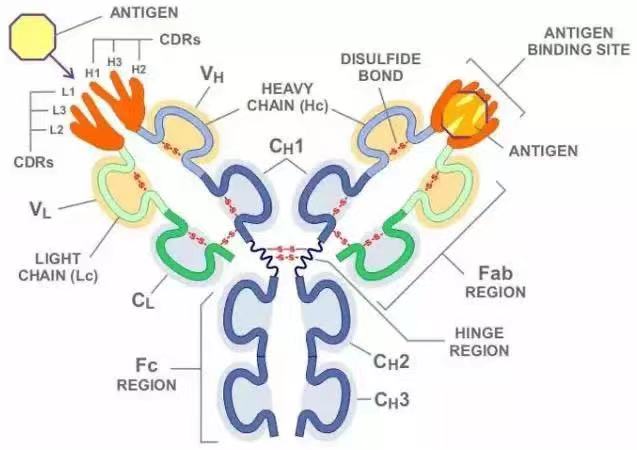
抗體(tǐ),又(yòu)稱為免疫球蛋白(bái)(immunoglobulin,簡稱Ig),是一(yī)種主要由漿細胞分(fēn)泌,被免疫系統用來鑒别與中(zhōng)和外(wài)來物(wù)質如細菌、病毒等病原體(tǐ)的大(dà)型Y形蛋白(bái)質,僅被發現存在于脊椎動物(wù)的血液等體(tǐ)液中(zhōng),及其B細胞的細胞膜表面。抗體(tǐ)能通過其可變區唯一(yī)識别特定外(wài)來物(wù)的一(yī)個獨特特征,該外(wài)來目标被稱為抗原(Antigen)。蛋白(bái)上Y形的其中(zhōng)兩個分(fēn)叉頂端都有一(yī)被稱為互補位(抗原結合位)的鎖狀結構,該結構僅針對一(yī)種特定的抗原表位。這就像一(yī)把鑰匙隻能開(kāi)一(yī)把鎖一(yī)般,使得一(yī)種抗體(tǐ)僅能和其中(zhōng)一(yī)種抗原相結合。 抗體(tǐ)和抗原的結合完全依靠非共價鍵的相互作用,這些非共價鍵的相互作用包括氫鍵、範德華力、電(diàn)荷作用和疏水作用。這些相互作用可以發生(shēng)在側鍊或者多肽主幹之間。正因這種特異性的結合機制,抗體(tǐ)可以“标記”外(wài)來微生(shēng)物(wù)以及受感染的細胞,以誘導其他免疫機制對其進行攻擊,又(yòu)或直接中(zhōng)和其目标,例如通過與入侵和生(shēng)存至關重要的部分(fēn)相結合而阻斷微生(shēng)物(wù)的感染能力等。針對不同的抗原,抗體(tǐ)的結合可能阻斷緻病的生(shēng)化過程,或者召喚巨噬細胞消滅外(wài)來物(wù)質。而抗體(tǐ)能夠與免疫系統的其它部分(fēn)交互的能力,是通過其Fc區底部所保留的一(yī)個糖基化座實現的。體(tǐ)液免疫系統的主要功能便是制造抗體(tǐ)。抗體(tǐ)也可以與血清中(zhōng)的補體(tǐ)一(yī)起直接破壞外(wài)來目标。
抗體(tǐ)是一(yī)種高分(fēn)子球狀血液蛋白(bái)質,重量約為150kDa。由于在部分(fēn)氨基酸殘基中(zhōng)含有糖鍊,抗體(tǐ)也是一(yī)種糖蛋白(bái)。能發揮功能的基本單位是一(yī)個免疫球蛋白(bái)單體(tǐ)。在分(fēn)泌形态的抗體(tǐ)中(zhōng)包括:二聚體(tǐ)IgA、真骨附類魚的四聚體(tǐ)IgM以及哺乳動物(wù)的五聚體(tǐ)IgM。
抗體(tǐ)的單體(tǐ)是一(yī)個Y形的分(fēn)子,有4條多肽鍊組成。其中(zhōng)包括兩條相同的重鍊,以及兩條相同的輕鍊,之間由雙硫鍵連接在一(yī)起。每一(yī)條鍊均由稱為免疫球蛋白(bái)結構域的多個結構域所組成。每一(yī)個結構域大(dà)約包含70至110個氨基酸,并根據大(dà)小(xiǎo)和功能分(fēn)門别類。例如可變域IgV以及恒定域IgC。它們的折疊方式很特别:通過兩次β折疊将另一(yī)條鍊卷入其中(zhōng)形成三明治狀,互相之間通過半胱氨酸和其它帶電(diàn)荷氨基酸緊密結合。
哺乳動物(wù)的免疫球蛋白(bái)重鍊有5種,分(fēn)别用希臘字母記為:α、δ、ε、γ以及μ。根據重鍊類型的不同,抗體(tǐ)被分(fēn)為不同的種型,它們被發現依序分(fēn)别存在于抗體(tǐ)IgA、IgD、IgE、IgG以及IgM中(zhōng)。不同的重鍊其大(dà)小(xiǎo)和組成各不相同:α和γ大(dà)約有450個氨基酸組成,而μ和ε大(dà)約有550個氨基酸組成。
1. 抗原結合區(Fab)
2. 抗原結晶區(Fc)
3. 藍(lán)色的重鍊有一(yī)個可變區(VH),緊随其後的一(yī)個恒定區(CH1),一(yī)個樞紐區,以及另兩個恒定區(CH2 and CH3)組成
4. 綠色的輕鍊包含一(yī)個可變區(VL)以及一(yī)個恒定區(CL)
5. 抗原結合點
6. 樞紐區.
在鳥類的血液和蛋清中(zhōng),還發現了被稱為IgY的血清抗體(tǐ)種型。這種抗體(tǐ)種型和哺乳動物(wù)的IgG有很大(dà)的區别。然而在一(yī)些舊(jiù)資(zī)料,甚至是生(shēng)命科學商(shāng)業産品的網站上,仍然稱之為IgG。這是錯誤的,并且容易引起混淆。
每一(yī)條重鍊有兩個區域:恒定區與可變區。同種型的抗體(tǐ),其恒定區都是一(yī)樣的,但不同種型之間該區域是不相同的。例如:γ、α以及δ型重鍊由三個免疫球蛋白(bái)結構域串聯而成,并且還有一(yī)個用于增加彈性的鉸鍊區;而μ及ε型重鍊則包括四個免疫球蛋白(bái)結構域。不同B細胞所生(shēng)産抗體(tǐ)的重鍊可變區是不同的,但是同一(yī)個B細胞及其克隆體(tǐ)所生(shēng)産的不同種型抗體(tǐ)的可變區則是完全相同的。重鍊的可變區由一(yī)個結構域組成,包含大(dà)110個氨基酸。
免疫球蛋白(bái)輕鍊由大(dà)約211至217個氨基酸組成,分(fēn)為兩個結構域,分(fēn)别是恒定區和可變區。哺乳動物(wù)的輕鍊有兩種,分(fēn)别命名為λ(lambda)和κ(kappa)。每一(yī)個抗體(tǐ)的兩個輕鍊的恒定區永遠是完全相同的,例如對于哺乳動物(wù)而言,同一(yī)個抗體(tǐ)要麼是λ型,要麼是κ,不會同時存在。在如軟骨魚綱(鲨魚)及真骨下(xià)綱的低級脊椎動物(wù)中(zhōng),還可發現其它類型的輕鍊,如ι(iota)型。
抗體(tǐ)的某些部分(fēn)具有獨特的功能。比如說Y形的臂區,包含了兩個可以結合抗原的位點,是識别外(wài)來物(wù)的關鍵所在。該區域被稱為Fab區,即抗原結合區段(fragment, antigen binding)。無論是重鍊還是輕鍊,抗原結合區段均包括一(yī)個可變區與一(yī)個恒定區,其中(zhōng)可變區的互補位成型于抗體(tǐ)單體(tǐ)氨基酸鍊的末端。可變區又(yòu)被稱為Fv區,是與抗體(tǐ)結合的最關鍵區域,無論是輕鍊還是重鍊都包含該區域。實際上可變區的變化并非随機或者均勻散布的。更具體(tǐ)的說,這些變化分(fēn)布在三個可變的β折疊-轉角上,該區域被稱為互補決定區(Complementarity Determining Region,CDR),也叫做高變區。在免疫網絡理論中(zhōng),每個抗體(tǐ)的互補決定區又(yòu)被稱為獨特型或者基因型。适應性免疫系統的适應過程,就是依靠有各個獨特型之間的互動來進行調整的。
------------------------------------------------
參閱文獻:
1.Rhoades RA, Pflanzer RG (2002). Human Physiology (4th ed.). Thomson Learning. p. 584. ISBN 0-534-42174-1.
2.Charles Janeway (2001). Immunobiology. (5th ed.). Garland Publishing. ISBN 0-8153-3642-X. (electronic full text via NCBI Bookshelf)
3. Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 1-55581-246-5.
4.Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion". Immunol. Res. 36 (1–3): 27–32. doi:10.1385/IR:36:1:27. PMID 17337763
5.參考資(zī)料:https://en.wikipedia.org/wiki/Antibody


