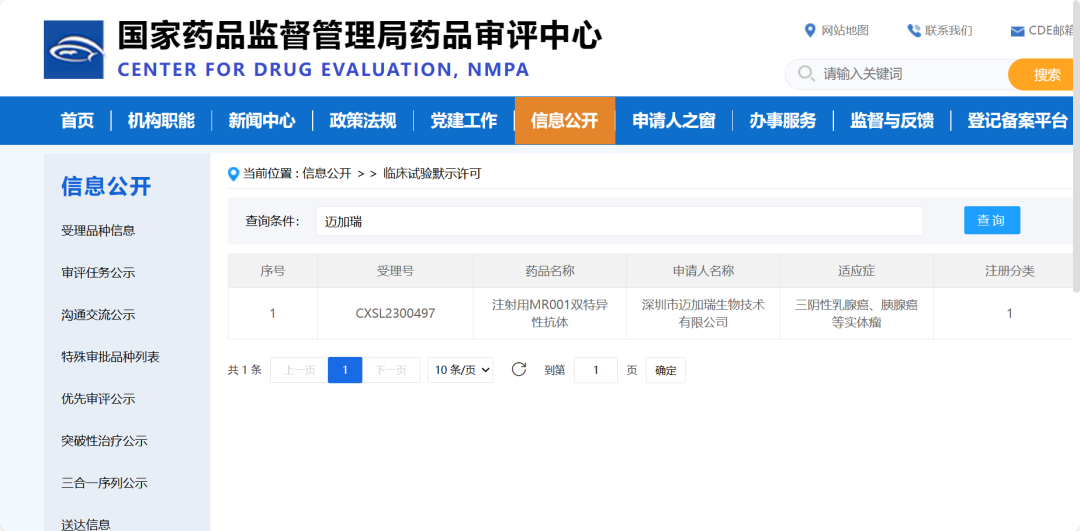
1
MR001是邁加瑞生(shēng)物(wù)擁有完全自主知(zhī)識産權的1類生(shēng)物(wù)創新藥,在臨床前動物(wù)實驗中(zhōng)顯示出廣譜、顯著的抗實體(tǐ)瘤療效。當前我(wǒ)(wǒ)國每年新發癌症患者超過450萬人,MR001将滿足胰腺癌、三陰性乳腺癌等多種惡性實體(tǐ)瘤的臨床需求并造福廣大(dà)患者,預計将産生(shēng)巨大(dà)的經濟效益和社會效益。
2
邁加瑞生(shēng)物(wù)與南(nán)方醫科大(dà)學南(nán)方醫院GCP中(zhōng)心建立了合作關系,拟開(kāi)展的臨床試驗在世界範圍内屬于首次人體(tǐ)試驗(First-in-Human,FIH),具有突破創新的重大(dà)意義。本次Ⅰ期臨床試驗方案采用單臂、開(kāi)放(fàng)性、劑量遞增設計,預計納入16~31例晚期實體(tǐ)瘤患者,評價雙特異性抗體(tǐ)MR001的安全性和耐受性、确定MR001的劑量限制性毒性 (DLT)和最大(dà)耐受劑量 (MTD),初步探明MR001有效性、藥代動力學特征、藥效動力學特征。
3
接下(xià)來,各方将緊鑼密鼓的開(kāi)展Ⅰ期臨床實驗,預計11月份即開(kāi)展首例受試者入組工(gōng)作,邁出取得真實世界數據的第一(yī)步。
漢騰助力
該雙特異性抗體(tǐ)項目運用漢騰的平台技術,曆時20個月完成IND申報的整個藥學研究内容。
雖然該項目曾面對上海新冠疫情的影響,漢騰供應鍊團隊多渠道采購進口物(wù)料,以保證項目的生(shēng)産。此外(wài),面對開(kāi)發過程中(zhōng)出現的蛋白(bái)在液體(tǐ)中(zhōng)不穩定現象,漢騰制劑團隊在4周内,成功篩選出穩定的凍幹制劑處方。助力本項目首次從15L的小(xiǎo)試工(gōng)藝,直接成功放(fàng)大(dà)到500L的中(zhōng)試生(shēng)産規模。
目前,漢騰生(shēng)物(wù)已成功助力 44+合作項目成功取得臨床試驗批件,13+個合作項目取得上市批件。
關于邁加瑞生(shēng)物(wù)
深圳市邁加瑞生(shēng)物(wù)技術有限公司于2019年在深圳成立,是一(yī)家将生(shēng)命科學、醫學基礎性研究與醫藥開(kāi)發融為一(yī)體(tǐ)的生(shēng)物(wù)技術公司。公司聚焦于癌症、神經退行性疾病、自身免疫病以及病毒感染性疾病的治療,主要藥物(wù)研發類型有單克隆抗體(tǐ)、雙特異性抗體(tǐ)、mRNA載體(tǐ)、腺病毒載體(tǐ)、CAR-T細胞等,緻力于通過安全、有效的重磅藥物(wù)造福患者和社會。


